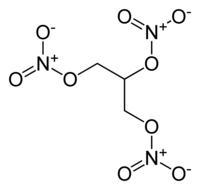
La NG fu il primo esplosivo facilmente producibile, più forte della polvere nera. Fu scoperta dal chimico Ascanio Sobrero nel 1847, che lavorava per TJ Pelouze all'Università di Torino. Inizialmente egli chiamò la sua scoperta piroglicerina, e avvisò vigorosamente contro il suo uso in alcune lettere private e in un articolo di giornale, affermando che era estremamente pericoloso e impossibile da maneggiare.
Uno degli studenti compagni di Sobrero fu Alfred Nobel, che portò la formula a casa in Svezia e sperimentò più sicuri modi per maneggiare la pericolosa sostanza; il suo fratello minore Emil e molti altri lavoratori furono uccisi nel 1864 in un'esplosione causata dalla NG nell'armeria di famiglia a Heleneborg.
Un anno più tardi, Nobel fondò l'Alfred Nobel & Company in Germania, costruendo una fabbrica isolata tra le colline Krümmel a Geesthacht vicino Amburgo. Questà società esportava una combinazione liquida di NG e polvere da sparo conosciuta come "Blasting Oil", ma era estremamente instabile e difficile da trasportare, come mostrato dalle numerose catastrofi che si susseguirono. Gli stessi edifici della fabbrica a Krümmel furono distrutti in due occasioni.
Nell'aprile 1866, tre casse di NG vennero spedite in California per la Central Pacific Railroad, che desiderava sperimentare la capacità esplosiva della NG per velocizzare la costruzione del Summit Tunnel (506 m) attraverso la Sierra Nevada. Una delle casse esplose, distruggendo un ufficio Wells Fargo a San Francisco e uccidendo 15 persone, portando al bando sul trasporo di NG liquida in California. La fabbricazione in sito della NG fu quindi richiesta per la rimanente perforazione ed esplosione delle rocce più dure al fine di completare la prima ferrovia transcontinentale d'America.
La NG liquida fu diffusamente bandita dappertutto come tale, e questo portò finalmente allo sviluppo da parte della Alfred Nobel & Company della dinamite nel 1867, prodotta miscelando alla NG della terra di diamotemee (farina fossile) trovata sulla colline di Krümmel. Misture simili, quali dualine (1867), lithofracteur (1869), e gelignite (1875), miscelate a NG con altri assorbenti interti - molte combinazioni differenti furono testate per permettere a Nobel di brevettarle. Dinamite contentente nitrocellulosa, che aumenta la viscosità della miscela, sono comunemente note come "gelatine."
In seguito alla scoperta che il nitrito di amile aiutava ad alleviare il dolore al torace, il dott. William Murrell sperimentò l'uso di NG per alleviare l'angina pectoris e ridurre la pressione sanguigna. Iniziò a trattare i pazienti con piccole dosi nel 1878, ed essa fu presto adottata nell'uso comune dopo che pubblicò i suoi risultati su The Lancet nel 1879. La decisione medica di usare il nome "gliceril trinitrato" o "trinitrina" venne presa per evitare che i pazienti associassero il nome di NG alle esplosioni.
Nella sua forma pura, la NG è un esplosivo di contatto (shock fisico può causare la sua detonazione) e degrada col passare del tempo a forme molto più instabili. Questo la rende estremamente pericolosa per il trasporto e l'uso. In questa forma non diluita, è una degli esplosivi più potenti, comparabile ai più recentemente sviluppato RDX e PETN, così come all'esplosivo plastico C-4 — che contiene più del 90% di RDX quale ingrediente attivo.
Sino dalle prime esperienze storiche fatta con la NG, fu scoperto che la NG liquida poteva essere "desensibilizzata" raffreddandola a 5-10 °C, temperatura alla quale congela, contraendosi fino alla solidificazione. Comunque, il successivo scongelamento può essere estremamente sensibilizzante, specialmente se le impurezze sono presenti o se il riscaldamento è troppo rapido. È possibile "desensibilizzare" chimicamente la NG al punto in cui può essere considerata approssimativamente "sicura" come nella più moderne formulazioni degli esplosivi ad alto potenziale, attraverso l'aggiunta di etanolo al 10-30% approssimativamente, acetone, o dinitrotoluene (le % variano con l'agente desensibilizzante usato).
La NG e tutti i diluenti usati possono certamente deflagrare o bruciare. Comunque, il potere esplosivo della NG è derivato dalla detonazione: l'energia dalla decomposizione iniziale causa un gradiente di pressione che detona il carburante che sta attorno. Questo può generare un'onda d'urto auto-sostenuta che propaga attraverso il mezzo ricco di carburante ad una velocità che può essere pari o superiore a quella del suono con una decomposizione a cascata del carburante in gas.
L'esposizione saltuaria ad elevate dosi di NG può causare forti mal di testa noti come "NG head". Questi mal di testa possono essere forti abbastanza da inabilitare alcune persone; comunque, gli uomini sviluppano una tolleranza e una dipendenza dalla NG dopo un'esposizione a lungo termine. L'astinenza (raramente) può essere fatale; i sintomi di astinenza includono mal di testa e problemi di cuore; con la ri-esposizione alla NG, questi sintomi possono sparire.
Per i lavoratori esposti alla NG, questo puà risultare in un fenomeno noto come "Monday morning headache" per coloro che sperimentano una esposizione regolare alla NG sul posto di lavoro portando ad una tollerenza verso la NG a causa dei suoi effetti dilatatori. Durante il weekend i lavoratori perdono la tolleranza verso la NG e quando al lunedì sono ri-esposti alla NG la pronunciata vasodilatazione produce tachicardia, vertigini, e un mal di testa.


 9Mi piace
9Mi piace LinkBack URL
LinkBack URL About LinkBacks
About LinkBacks




 Rispondi citando
Rispondi citando

